PROTEÍNAS
Concepto:


Concepto:
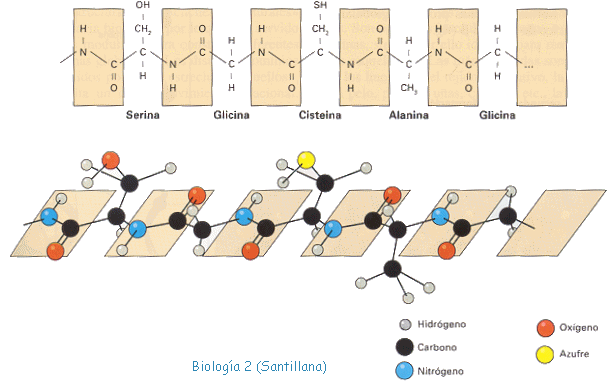
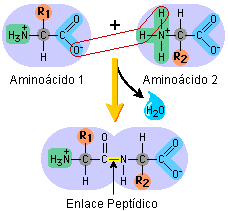
- Proteínas: Las proteínas son macromoléculas compuestas por carbono, hidrógeno, oxígeno y nitrógeno. La mayoría también contienen azufre y fósforo. Las mismas están formadas por la unión de varios aminoácidos, unidos mediante enlaces peptídicos

- Aminoácidos: Un aminoácido es una molécula orgánica con un grupo amino (-NH2) y un grupo carboxilo (-COOH)
Enlace peptidico
- Biuret: Método que sirve para identificar la presencia de 2 o mas enlaces peptídicos en un compuesto 20 gotas (1,0ml) de NaOH al 10% y 4 gotas de solución CuSO4 (base fuerte) al 1%. El reactivo de Biuret contiene CuSO4 en solución acuosa alcalina . La reacción se basa en la formación de un compuesto de color violeta, debido a la formación de un complejo de coordinación entre los iones Cu2+ y los pares de electrones no compartidos del nitrógeno que forma parte de los enlaces peptídicos. Cuando una proteína se pone en contacto con un medio fuertemente alcalino (álcali concentrado), se forma una sustancia compleja denominada biuret , de fórmula:
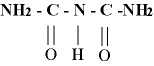 |
la cual, en contacto con una solución de CuSO4 diluída, da una coloración violeta Cuanto mas fuerte este violeta, mayor es la concentración de este peptido en la solucion.

- Xantoproteica:
10 gotas (0,5ml) de HNO3 concentrado
Esta reacción es característica de los grupos fenilo en la molécula proteica. Para esta prueba se produce la nitración del anillo bencénico presente en los aminoácidos obteniéndose nitrocompuestos de color amarillo.

Para acelerar esta reaccion calentaremos los compuestos, no directamente sino a baño maria
PROTEÍNAS I: Estudio de algunas sustancias
Objetivo: Identificar presencia de proteinas en las sustancias (biuret) y en caso de haber, si estas tienen restos aromáticos(xantoproteica)
Las sustancias a estudiar son: Caseina, Gelatina, Aspartamo, Ovoalbumina y Glicina
- Caseina:
Es una proteina de caracter acido debido a su elevada proporcion de aminoacidos acidos (punto isoelectrico=4,6). La caseina humana es mas rica en cistina y en glucidos que la vaca lo que la hace mas apropiada para el bebe. Reacciona con las bases formando caseinatos utilizados en la industria para la fabricacion de colas y adhesivos.Tambien se usa en industia textil.
La caseina precipita por acción de los ácidos. Esto puede ocurrir a traves de la formacion de acido lactico por la accion bcteriana sobre la lactosa o mediante el agregado de un acido hasta alcanzar el pH correspondiente a su punto isoeléctrico. La precipitacion puede producirse por la acción enzimatica de la quimiotripsina.
No tenemos caseina pura, por tanto tendremos que extraerla de la leche
- Leche: es
- una emulsion de materia grasa(principalmente triaciliglicéridos) en un medio acuoso
- Una suspención de materia proteica(caseina, albumina, globulina) en medio acuoso
- Una solucion acuosa de sales minerales y lactosa
Contiene ademas cantidades menore de lectina, vitaminas, enzimas, nucleotidos y gases disueltos
Materiales y sustancias:
vaso de bohemia
varilla de vidrio
mechero
soporte
tela metálica
gradilla
tubos de ensayo
termómetro
papel de filtro
leche descremada
acido etanioco 2,0M
Hidroxido de sodio al 10%
Sulfato cuprico al 1%
acido nitrico concentrado
Procedimiento:
- Coloque aproximadamente 25ml de leche descremada en un vaso de Bohemia grande
- Caliente hasta aproximadamente 40°C agitando con varilla de vidrio.(no mas de eso porque proteinas como la lactoalbumina pueden desnaturalizarse con tan altas temperaturas)
- Adicione acido etanoico 2,0M gota a gota agitando en forma continua hasta coagulacion total *Al hacer esto modificamos el pH del medio posibilitando la precipitacion de la caseina ya que esta se encuetra en la leche en forma de micelas, facilmente separadas por precipitacion isoelectrica
- Seque cuidadosamente la caseina con ayuda del papel de filtro
- Separe dos porciones del solido obtenido de aprox 1cm3 y coloquelas en dos tubos de ensayo
Producto final
paso 2
Ya extraida la caseina se puede comenzar con la parte de la caracterizacion de esta sustancia
a) Haremos biuret en uno de los tubos de ensayo de la muestra: 20 gotas de NaOH 10% Y 2 gotas de solucion CuSO4 al 1%
RESULTADO:
La caseina con el metodo biuret resulta en una sustancia violeta, lo cual nos determina que en la caseina existen enlaces peptidicos cuyos nitrogenos con pares de electrones sin compartir se coordinan con el Cu2+ . Podemos confirmar que la caseina es un peptido y hasta tal vez por la consistencia del violeta poder fundamentar que es una proteina(gran concentracion de enlaces peptidicos) lo que luego nos confirma que de positivo en la xantoproteica
b)Al otro tubo le haremos una reacción xantoproteica agregandole 10 gotas de HNO3 concentrado, espere un par de minutos
RESULTADO:
La caseina también da positivo con la xantoproteica lo que refiere a que es una proteina y que en ella hay restos aromáticos. Observando la estructura de la caseina de mas arriba, vemos que ciertamente, tiene restos aromaticos
BIURET y XANTOPROTEICA respectivamente
Procedimiento:
a) Preparar gelatina y separar en dos tubos
b) Hacer biuret en uno de los tubos

Observamos que la reaccion con biuret da positivo lo que nos habla de la presencia de 2 o mas
enlaces peptidicos. Por lo que podemos decir que hay un peptido o posiblemente una proteina.
b) Realizar la xantoproteica

Da negativo, la gelatina no posee restos aromaticos.
A tener en cuenta, la xantoproteica en la gealtina podria dar un vago positivo por elementos comerciales que se le agregan a la gelatina, pero teoricamente, no deberia.
 El aspartamo es un edulcorante no calórico,es estable cuando se encuentra seco o congelado, pero se descompone y pierde su poder edulcorante con el transcurso del tiempo, cuando se conserva en líquidos a temperaturas superiores a 30 °C.La dulzura relativa del aspartamo es de 150 a 200 veces más dulce que el azúcar. Es necesario destacar que todos los edulcorantes se clasifican con respecto a la sacarosa o azúcar común, por lo que el valor de 200 veces es obtenido en comparación con diluciones hechas en laboratorio de sacarosa.
El aspartamo es un edulcorante no calórico,es estable cuando se encuentra seco o congelado, pero se descompone y pierde su poder edulcorante con el transcurso del tiempo, cuando se conserva en líquidos a temperaturas superiores a 30 °C.La dulzura relativa del aspartamo es de 150 a 200 veces más dulce que el azúcar. Es necesario destacar que todos los edulcorantes se clasifican con respecto a la sacarosa o azúcar común, por lo que el valor de 200 veces es obtenido en comparación con diluciones hechas en laboratorio de sacarosa.
Procedimiento:
a) Colocar 4 gotas de aspartamo en 2 tubos de ensayo diferentes
b) Realizar biuret en uno de ellos(izquierda)
c)Realizar xantoproteica al otro(derecha)
Procedimiento:
 La glicina es uno de los aminoácidos que forman las proteínas de los seres vivos. Es el aminoácido más pequeño y el único no quiral de los 20 aminoácidos presentes en la célula. La glicina no es esencial en la dieta humana, ya que todas las células tienen la capacidad de sintetizarla. Hay dos vías para sintetizarla: la fosforilada y la no-fosforilada.
La glicina es uno de los aminoácidos que forman las proteínas de los seres vivos. Es el aminoácido más pequeño y el único no quiral de los 20 aminoácidos presentes en la célula. La glicina no es esencial en la dieta humana, ya que todas las células tienen la capacidad de sintetizarla. Hay dos vías para sintetizarla: la fosforilada y la no-fosforilada.

La caseina con el metodo biuret resulta en una sustancia violeta, lo cual nos determina que en la caseina existen enlaces peptidicos cuyos nitrogenos con pares de electrones sin compartir se coordinan con el Cu2+ . Podemos confirmar que la caseina es un peptido y hasta tal vez por la consistencia del violeta poder fundamentar que es una proteina(gran concentracion de enlaces peptidicos) lo que luego nos confirma que de positivo en la xantoproteica
b)Al otro tubo le haremos una reacción xantoproteica agregandole 10 gotas de HNO3 concentrado, espere un par de minutos
RESULTADO:
La caseina también da positivo con la xantoproteica lo que refiere a que es una proteina y que en ella hay restos aromáticos. Observando la estructura de la caseina de mas arriba, vemos que ciertamente, tiene restos aromaticos
CASEINA
BIURET y XANTOPROTEICA respectivamente
- GELATINA: La gelatina es una proteína compleja, es decir, un polímero compuesto por aminoácidos. Como sucede con los polisacáridos, el grado de polimerización, la naturaleza de los monómeros y la secuencia en la cadena proteica determinan sus propiedades generales. Una notable propiedad de las disoluciones de esta molécula es su comportamiento frente a temperaturas diferentes: son líquidas en agua caliente y se solidifican en agua fría.Al ser proteína en estado puro, ésa es su mayor propiedad nutritiva: proteína (84-90%), sales minerales (1-2%) y agua (el resto).
Procedimiento:
a) Preparar gelatina y separar en dos tubos
b) Hacer biuret en uno de los tubos

Observamos que la reaccion con biuret da positivo lo que nos habla de la presencia de 2 o mas
enlaces peptidicos. Por lo que podemos decir que hay un peptido o posiblemente una proteina.
b) Realizar la xantoproteica

Da negativo, la gelatina no posee restos aromaticos.
A tener en cuenta, la xantoproteica en la gealtina podria dar un vago positivo por elementos comerciales que se le agregan a la gelatina, pero teoricamente, no deberia.
- Asparmato:
 El aspartamo es un edulcorante no calórico,es estable cuando se encuentra seco o congelado, pero se descompone y pierde su poder edulcorante con el transcurso del tiempo, cuando se conserva en líquidos a temperaturas superiores a 30 °C.La dulzura relativa del aspartamo es de 150 a 200 veces más dulce que el azúcar. Es necesario destacar que todos los edulcorantes se clasifican con respecto a la sacarosa o azúcar común, por lo que el valor de 200 veces es obtenido en comparación con diluciones hechas en laboratorio de sacarosa.
El aspartamo es un edulcorante no calórico,es estable cuando se encuentra seco o congelado, pero se descompone y pierde su poder edulcorante con el transcurso del tiempo, cuando se conserva en líquidos a temperaturas superiores a 30 °C.La dulzura relativa del aspartamo es de 150 a 200 veces más dulce que el azúcar. Es necesario destacar que todos los edulcorantes se clasifican con respecto a la sacarosa o azúcar común, por lo que el valor de 200 veces es obtenido en comparación con diluciones hechas en laboratorio de sacarosa.Procedimiento:
a) Colocar 4 gotas de aspartamo en 2 tubos de ensayo diferentes
b) Realizar biuret en uno de ellos(izquierda)
c)Realizar xantoproteica al otro(derecha)
Observamos que ambos dan negativo, ni la xantoproteica da amarillo ni biuret violeta, por tanto el aspartamo no tiene enlaces peptidicos cuyos N realicen complejos de coordinacion con el Cu2+, lo que determina también que de negativo con la xantoproteica ya que al no tener enlaces peptidicos como vimos por biuret, no puede ser una proteina dando tambien negativo en la reaccion xantoproteica que da positiva con proteinas con restos aromaticos.
- Ovoalbumina
La ovoalbúmina es la principal proteína de la clara del huevo (60-65% del peso de la clara de huevo). Pertenece a la superfamilia proteínica de las serpinas, aunque a diferencia de la mayoría de éstas la ovoalbúmina no es capaz de inhibir cualquier peptidasa.Es llamada fosfoglucoproteína integrada por tres fracciones, A1, A2 y A3, en una proporción de 85:12:3, respectivamente, que se diferencian por su contenido en fósforo. Es rica en cisteína y metionina y presenta grupos sulfhidrilos.
Procedimiento:
a) Colocar clara de huevo en 2 tubos de ensayo diferentes.
b) Realizar Biuret a uno
c)Xantoproteica a otro
para acelerar reacción xantoproteica e intensificar el color le agregamos NaOH y calentamos un poco
Ambas reacciones dan positivo, al igual que la caseina, la ovoalbumina tiene enlaces peptídicos como lo determina biuret. Y es una proteina con restos aromaticos como determina la xantoproteica
- Glicina:
 La glicina es uno de los aminoácidos que forman las proteínas de los seres vivos. Es el aminoácido más pequeño y el único no quiral de los 20 aminoácidos presentes en la célula. La glicina no es esencial en la dieta humana, ya que todas las células tienen la capacidad de sintetizarla. Hay dos vías para sintetizarla: la fosforilada y la no-fosforilada.
La glicina es uno de los aminoácidos que forman las proteínas de los seres vivos. Es el aminoácido más pequeño y el único no quiral de los 20 aminoácidos presentes en la célula. La glicina no es esencial en la dieta humana, ya que todas las células tienen la capacidad de sintetizarla. Hay dos vías para sintetizarla: la fosforilada y la no-fosforilada.
Procedimiento:
1)Colocar una pizca de glicina en dos tubos de ensayo diferentes
2) Diluir con algo de agua
3) Realizar Biuret en un tubo (derecha)
4)Realizar xantoproteica en el otro(izquierda)

Ambos dan negativo, en este caso porque estamos en presencia de un aminoácido solo, no unido a otro por esto no se forman enlaces peptídicos lo que hace que no de una sustancia violeta con biuret. La xantoproteica da negativo simplemente porque la glicina no es una proteina con restos aromaticos si bien puede conformar una.

Biuret: glicina - ovoalbumina- aspartamo- gelatina- caseina
Xantoproteica: gicina-ovoalbumina-aspartamo-gelatina-caseina
muestra
|
biuret
|
Xantoproteica
|
Caseína
|
(+)
|
(+) tinción fuerte
|
Gelatina
|
(+)
|
(-)
|
Aspartamo
|
(-)azulada
|
(-)
|
Ovoalbúmina
|
(+)violeta clarito
|
(+)aplicando calor y NaOH para insentificacion de color
|
Glicina
|
(-) azul clarito
|
(-)
|
PROTEINAS II: Diálisis
Concepto:
- Diálisis: Separación de las sustancias que están juntas o mezcladas en una misma solución, a través de una membrana que las filtra.
- Osmosis: La ósmosis u osmosis es un proceso físico-químico que hace referencia al pasaje de un disolvente entre dos disoluciones que están separadas por una membrana con características de semipermeabilidad. Estas disoluciones, por otra parte, poseen diferente concentración.
El liquido o gas se va a mover desde la solucion menos concentrada(con menos soluto) a la mas
- Difusión: pasaje de particulas por medio de una membrana semipermeable desde un lugar donde se encuentran en mayor concentracion hacia uno de menor concentracion hasta que las concentraciones se igualen.
Procedimiento:


1. Colocamos agua destilada hasta la mitad en un vaso de bohemia grande
2. Diluimos gelatina(o cualquier proteína globular estable en el medio acuoso) en poca agua y la colocamos en un recipiente con dos aperturas(ej,media botella) que en una de ellas tenga una membrana semipermeable(estructura que contiene poros o agujeros, de tamaño molecular,deja pasar determinadas sustancias), como un celofan. Agregamos tambien a esta solucion algunas gotas de NaCl.
3. Hundimos el recipiente 2 con la membrana hacia abajo en el recipiente 1.
El agua destilada por ósmosis tenderá ir a la solución más concentrada (recipiente 2) hasta que las concentraciones en ambos recipientes se igualen alcanzando un equilibrio osmótico gracias a que existe una presión externa. A si mismo, las partículas por difusión tienden a ir a la solución menos concentrada lo que determina que en el vaso de bohemia termine habiendo iones de Na y Cl, no de gelatina por su mayor tamaño de partícula.
4. Esperamos un tiempo para que los procesos ocurran
La osmosis es visible, el agua destilada del recipiente 1 pasa al 2
5. Con un gotero tomamos 2 muestras de ambos recipientes y las colocamos en 4 tubos de ensayo diferentes
La osmosis es visible, el agua destilada del recipiente 1 pasa al 2
5. Con un gotero tomamos 2 muestras de ambos recipientes y las colocamos en 4 tubos de ensayo diferentes
5. Tomamos una muestra de cada recipiente y le aplicamos el método de biuret.
Observaciones:
1. La muestra del recipiente pequeño queda violeta lo que significa un resultado positivo del método biuret que se encarga de identificar la presencia de proteínas, por lo que sabemos que allí hay gelatina.
El tubo con la muestra de recipiente grande da negativo con biuret ya que queda una solución de color azul lo que determina una ausencia de proteínas confirmándonos que el tamaño de partícula de esta, es mayor que la del filtro no permitiendo a que pase desde el recipiente pequeño.
El tubo de la derecha es el del recipiente grande(dio negativo con biuret)
El tubo de la izquierda es el del recipiente pequeño(dio positivo con biuret)
6. A los otros dos tubos se les colocan algunas gotas de AgNO3
Observaciones:
En los tubos de ambas muestras de ambos recipientes quedan soluciones blancas lo que determina la presencia de anión cloruro. Esto refiere a la difusión que ocurrió por medio de la membrana semipermeable que hizo que quedarán concentraciones iguales de este ión en ambos recipientes.
El Cl- tiene el tamaño de partícula como para pasar por medio de esta membrana a diferencia de esta gelatina. Damos por centado que si el Cl- pasó el Na+ también por tener un tamaño menor.
¿Como funciona el AgNO3?
En agua, el nitrato de plata (AgNO3) se disocia:
AgNO3 >>> Ag + + NO3 -
Resultados con biuret Resultados con AgNO3
A la derecha muestra del recipiente grande A la derecha muestra de recipiente grande
A la izquierda muestra del recipiente pequeño A la izquierda muestra del recipiente pequeño
A la derecha muestra del recipiente grande A la derecha muestra de recipiente grande
A la izquierda muestra del recipiente pequeño A la izquierda muestra del recipiente pequeño
Después de realizada la diálisis
Muestra
|
Biuret
|
AgNo3
|
Interior
|
(+)
|
(+)
|
Exterior
|
(-)
|
(+)
|













No hay comentarios:
Publicar un comentario