Jabones y Detergentes
Objetivo:
Obtener un jabón y un detergente. Realizar el estudio comparativo de algunas de sus propiedades.
Materiales:
- Vaso de Bohemia grande
- 4 Probetas 10ml
- Capsula con trípode
- Gradilla con tubos de ensayo
- Pinzas para capsula y tubo
- 6 vasos de bohemia chicos
- Varilla de vidrio
- Espátula
- Cuenta gotas
- Piceta
- Mechero y fósforos
- Paño de limpieza
Sustancias
- Aceite de coco
- Etanol
- Solucion acuosa NaOH 1,0molar
- Solucion acuosa NaOH 8,0M
- Solución acuosa Cacl2 1%
- Urea
- Ácido alquil bencil sulfónico
- Rojo de metilo
- Aceite
- Agua
- Azufre(polvo)
Actividad experimental
1)Obtención del jabón
a) Fundir 15ml de aceite de coco en un vaso de bohemia pequeño
b) Agregar al vaso 6ml de etanol y 10ml de NaOH 8,0M
c) Introducir el vaso pequeño en otro vaso mas grande que contenga agua
d) Calentar el conjunto durante media hora, agitando permanentemente el contenido del vaso
pequeño(en caso que haya mucha producción de espuma, retirar momentáneamente el mechero y luego continuar). Si la mezcla adquiere mucha dureza agregar algo de agua
e) Moldear y dejar enfriar
Paso d) Con alteraciones para mayor rapidez. Se calienta vaso de bohemia pequeño directamente
contenido se va espesando y alejando de las paredes del recipiente.
Concepto:
- ¿Qué es un jabón? Cuando un éster y una base son puestos a reaccionar los productos son alcohol y una sal; si el éster es un triglicérido, esta sal será un jabón. Por tanto, es una sal de ácidos grasos (anión de la sustancia) y metales (catión de la sustancia).
2)Obtención de detergente
a) en un vaso de bohemia seco, colocar 20 gotas de ácido alquil bencil sulfónico. Lo usará mas adelante
b)Medir 10 ml de solución NaOH 1,0M y verter en otro vaso de bohemia. Agregarle a esta solucion aproximadamente 1g de urea y agitar hasta disolución total
c) Agregar al primer vaso de bohemia utilizando goteo y agitando 10 gotas de la ultima solución preparada
d)Adicionar una gota de rojo de metilo agitar y observar
e) Continuar agregando por goteo y por agitación la solución básica hasta observar cambio y así obtener el detergente deseado
- ¿Qué es un detergente? Un detergente se forma cuando el ester colocado a reaccionar con una base es el acido decil benceno sulfonico ya que el anion sulfonato que resulta no precipita en ningn solido vivalente con cation calcio o magnesio presentes en el agua dura.
Para colorearlos se puede usar un reactivo como fenoftaleina o azul de bromtimol que dado que indican con diferentes colores cuando etan en presencia de un medio basico. Y el jabon y detergente son basicos

ESTUDIO COMPARATIVO DE PROPIEDADES
a. Colocar un trozo (media cucharadita) del jabón obtenido, en un vaso de bohemia, agregar agua hasta un volumen de 60ml.
b. Calentar y agitar hasta disolución total
c. En otro vaso de Bohemia colocar agua hasta hasta un volumen de aproximadamente 15ml y agregar la mitad del detergente obtenido.
Homogeneizar mediante una varilla
d. Colocar en dos tubos de ensayo solución jabonosa y en otros dos tubos solucion detergente (aproximadamente 4ml de cada solución)
e. Acción emulsionanate
i. Agregar a un tubo con solucion jabonosa y a otro con solución de detergente 3 gotas de aceite. Agitar y obsevar.
MICRO
MACRO
El aceite queda emulsionado, acido carboxilicos rodean al aceite ya que ambos son apolares quedando la zona apolar (cola) hacia adentro y la cabeza polar hacia afuera interactuando con el agua
ii. Colocar en un tubo de ensayo aprox 4ml de agua y adicionar 3 gotas de aceite, Agitar y observar
Quedan dos fases, tienen diferentes densidades
la grasa en este caso en realidad es aceite, siendo la diferencia entre ellas su origen. En el aceite origen vegetal, grasa animal.

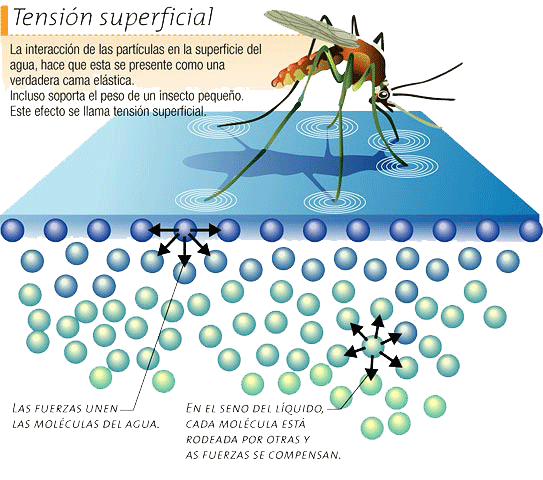
f. Efecto sobre la tensión superficial
i.Colocar en un vaso de Bohemia 50ml de agua
ii. Colocar en otro vaso de Bohemia 50ml de agua jabonosa
iii. En otro vaso de Bohemia diuir con agua la solución de detergente hasta un volumen de 50ml
iv. Espolvorear una pequeña cantidad de azufre en polvo sobre la superficie líquida de cada uno de
los 3 vasos de bohemia que contienen: agua, solución jabonosa y solución de detergente
v. Registrar observaciones
agua sola - detergente - jabón
En las soluciones de jabón y detergente el azufre se hunde porque la tensión superficial es menor ya que los aniones del jabón no permiten que las moleculas de agua realizen puentes de hidrógeno tan facilmente, interfieren haciendo menor la fuerza entre ellas.
esto ocurre en el agua sin jabon:
las pelotitas con colita representarian las moleculas de jabon o detergente, la cabeza polar con afinidad por el agua y la cola apolar. estas cabezas interfieren en los puentes de hidrogeno entre las moleculas de agua.
g. Efecto del catión calcio
i.Retirar dos tubos de ensayo de la gradilla, uno con solucion jabonosa y otro con solucion de detergente. Agitar para aumentar el volumen de espuma
ii.Agregar una gota de solucion acuosa de catión calcio a cada uno
iii. Anote las observaciones
Se forma agua dura, agua con cationes.
Precipita mas el de detergente, los jabones no limpian en "agua dura", agua que contiene cationes metalicos con carga(2+)princialmente calcio 2+ y magnesio 2+
En agua dura los acidos grasos del jabón y los cationes de esta forman solidos insolubles.
EXTRA
i. Agregar a un vaso de bohemia con agua, otro con solucion con detergente y otro con solucion jabonosa; carbón
ii. filtar los 3 resultado
sol. jabonosa - agua - detergente
abajo: solucion jabonosa, carbon emulsionado
medio: agua, carbón se hunde mas lento, al filtrar agua pasa
arriba: detergente
la solucion jabonosa y de detergente al filtrarse, pasa una sustancia gris, al estar el carbon emulsionado las particulas estan muy juntas , al igual que pasan las particulas emulsionadas por la fibra de la ropa al lavar.
El carbon queda emulsionado porque es apolar al igual que las colas de los acidos carboxílicos de los jabones y detergentes, esto permite que se "atraigan" esas zonas quedando emulsionado